Sodobna biomedicina ter spremljajoče znanosti, ki zdaj vse bolje razumejo molekularne procese in patološke spremembe v celicah, intenzivno raziskujejo ključna mesta za razvoj tarčnih zdravil. Vse pomembnejša tarča postaja imunoproteasom, ki ga je raziskovala skupina slovenskih znanstvenoraziskovalnih sodelavcev ter razvila nov tip spojin za njegovo selektivno zaviranje, dosežek pa objavila v prestižni mednarodni reviji Angewandte Chemie.
Interdisciplinarna skupina trinajstih slovenskih znanstvenikov in raziskovalcev – v tem času ena od le štirih v svetu – je s triletnim raziskovalnim projektom potrdila tri, za znanstvene kroge s tega področja pomembne stvari: selektivno delovanje novih spojin na imunoproteasom, zanimiv način delovanja molekul s kovalentno vezavo in ugodno dejstvo, da gre za nepeptidne molekule.
Kaj natančneje to pomeni, kar je v omenjeni ugledni reviji z visokim faktorjem vpliva objavljeno pod naslovom Nonpeptidic Selective Inhibitors of the Chymotrypsin-Like (beta5i) Subunit of the Immunoprotasome (Nepeptidni selektivni inhibitorji kimutripsinu podobne podenote (beta5i) imunoproteasoma, sta v pogovoru za Delo pojasnila prof. dr. Irena Mlinarič Raščan, mag. farm., prodekanja za znanstvenoraziskovalno področje na Fakulteti za farmacijo, in prof. dr. Stanislav Gobec, mag. farm., predstojnik Katedre za farmacevtsko kemijo z iste fakultete.
Kaj se dogaja
Zanimiva je cilindrična oblika tega beljakovinskega kompleksa s štirimi obroči, sestavljenimi iz sedmih samostojnih beljakovin. Podoben je nekakšnemu sodčku – in v poljudni razlagi njegove vloge ter načina delovanja se pogosto uporablja prav ta izraz ali pa še bolj nazorno »čistilec«. Razgradnja poškodovanih ali nepotrebnih proteinov namreč poteka v notranjosti omenjenega sodčka, kjer so razmeščena aktivna mesta tako imenovanih encimskih podenot s proteazno aktivnostjo; proces se imenuje proteoliza, to je kemična reakcija, ki cepi peptidne vezi. Nastajajo peptidni fragmenti, dolgi povprečno 7 aminokislin, ki se izločajo iz sodčka.
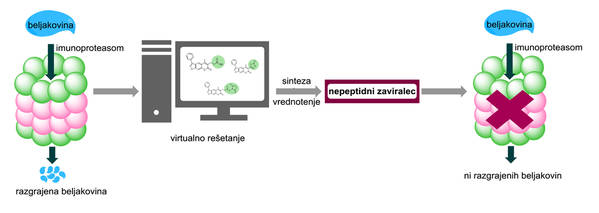
Shematski prikaz načrtovanja, sinteze in vrednotenja inhibitorjev imunoproteasoma.
Kapici – past
Pri tem imajo pomembno vlogo pri uravnavanju tega prehoda posebna pokrivala oziroma kapici na obeh straneh sodčka. Prepoznavata beljakovine, namenjene za razgradnjo, in omogočata njihovo delno razvitje, ker je vstop v sodčkast del tako ozek, da skozenj ne morejo prodreti normalno zvite beljakovine. Signal za razgradnjo v proteasomu je na beljakovino zaporedno vezanih več molekul ubikvitina. To je majhna beljakovina, ki se s posebnim encimom – ubikvitin ligaze – veže le na tiste beljakovine, ki jih prepozna kot poškodovane, odvečne oziroma neuporabne.
Opisano nemoteno delovanje omenjenega standardnega proteasoma je ključno za vzdrževanje homeostaze, to je ravnotežja v celici. Od njegovega normalnega delovanja so odvisni številni ključni procesi, kot je celični cikel, prepisovanje genov, apoptoza, to je programirana celična smrt, in imunski odziv.
Pri zdravljenju rakastih obolenj je proteasom že zdaj primerno tarčno mesto za delovanje zdravil proti raku, saj je rast tumorja odvisna tudi od razgradnje beljakovin, ki nadzirajo in po potrebi ustavijo delitev celic. Prvo tovrstno zdravilo za zdravljenje krvnega raka multiplega mieloma in velikoceličnega limfoma je bil bortezomib.
Lahko učinkoviteje pomaga »bližnji sorodnik«?
Raziskovalce na tem področju pa vse bolj zanima, kaj se dogaja v proteasomovem »bližnjem sorodniku« imunoproteasomu. To je za zdaj še precej slabo raziskana različica standardnega proteasoma v celicah imunskega sistema, ob vnetju ali pod vplivom oksidativnega stresa pa številni vnetni dejavniki sprožijo njegov nastanek tudi v drugih celicah.
Struktura onemogoča peroralno jemanje zdravil
Obe različici proteasoma sta v bolezenske procese največkrat vpleteni tako, da sta njuno izražanje in aktivnost močno povečana. V takšnih primerih je osnovni princip, kako ublažiti škodljivo delovanje in posledično zdraviti bolezenski proces, takšen, da se z dodajanjem zdravilne učinkovine zavre njuno aktivnost ali pa zniža njuno izražanje.
Na tržišču obstajata dve zdravili, ki sta zaviralca standardnega proteasoma, poleg že omenjenega bortezomiba še karfilzomib. Obe zdravili se uspešno uporabljata za zdravljenje multiplega mieloma, a imata določene pomanjkljivosti. Zaradi strukturnih značilnosti se morata zdravili aplicirati intravensko, pri čemer je za bortezomib na voljo tudi različica za podkožno aplikacijo.
Tak način zdravljenja je nujen zaradi peptidne osnovne strukture, saj bi se sicer molekuli, »zapakirani« v tableto ali kapsulo« za použitje, pod vplivom tako imenovanih peptidaz v organizmu prehitro razgradili. Ti encimi hitro pretvorijo obe molekuli v manjše in biološko neaktivne fragmente in tako seveda ne bi dosegli želenega učinka.

Doc. dr. Izidor Sosič, doc. dr. Martina Gobec, prof. dr. Stanislav Gobec in prof. dr.Irena Mlinarič-Raščan. Foto: Dragica Bošnjak
Dodatna slabost, ki je po besedah sogovornikov bolj izražena pri bortezomibu, pa je tudi veliko neželenih učinkov. Po razlagi strokovnjakov v znanstveni literaturi prevladuje mnenje, da je velik del neželenih učinkov posledica delovanja na standardni proteasom v zdravih in ne le rakavih celicah.
In tako so pred kratkim znanstveniki, ki se ukvarjajo z raziskovanjem razvoja zaviralcev proteasoma, postavili hipotezo, da bi s selektivnim zaviranjem imunoproteasoma lahko uspešno zdravili bolezni, pri katerih se kaže povečano delovanje in izražanje imunoproteasoma. Pri tem bi morali načrtovati takšne molekule, ki bi se selektivno vezale le na imunoproteasom, ne pa tudi na standardnega, da bi imeli manj neželenih učinkov zdravil.
Najprej v knjižnico
Raziskovalci – sodelavci Fakultete za matematiko, naravoslovje in informacijske tehnologije Univerze na Primorskem, Kemijskega inštituta in Instituta Jožef Stefan v Ljubljani: dr. Izidor Sosič, dr. Martina Gobec, dr. Boris Brus, Damjan Knez, dr. Matej Živec, dr. Janez Konc, Samo Lešnik, Mitja Ogrizek, prof. dr. Aleš Obreza, dr. Dušan Žigon, prof. dr. Dušanka Janežič, prof. dr. Irena Mlinarič Raščan in prof. dr. Stanislav Gobec – so se tako v omenjenem raziskovalnem projektu podali najprej v »virtualni svet«; med milijone spojin, ki so dostopne v digitalni obliki, da bi potem z izbranimi spojinami opravljali računalniške simulacije.
Z njimi poskušajo napovedati, kako se – ali pa ne – spojine iz knjižnic spojin prilegajo v aktivno mesto tarčnega proteina – imunoproteasoma. Za tem se, kot razlagata sogovornika, težišče dela prenese v »realni svet«, v laboratorij, kjer s kupljenimi izbranimi spojinami izvajajo poskuse na izoliranih encimih in celičnih linijah, s katerimi potrdijo ali ovržejo delovanje spojin, potencialnih zdravilnih učinkovin. V tem delu raziskave, pa praviloma tudi pozneje, odvisno od načrtovanja in uspešnosti projekta, se tesno, na »translacijsko« prepletajo aktivnosti farmacevtske kemije in molekularne farmakologije ter sodobnih farmakogenomskih pristopov.
Iskanje molekule
Prof. Irena Mlinarič-Raščan in prof. Stanislav Gobec ob tem poudarjata, da to pomeni, da jim je uspelo potrditi temeljno hipotezo, in sicer, da je selektivno zaviranje imunoproteasoma mogoče doseči tudi z majhnimi molekulami, ki nimajo peptidne strukture.

Prof. Irena Mlinarič-Raščan in prof. Stanislav Gobec. Foto: Dragica Bošnjak
Če bi bilo mogoče nadaljevati raziskave v tej smeri, bi nekoč morda lahko razvili učinkovitejša in varnejša zdravila za zdravljenje različnih avtoimunskih, vnetnih, rakavih in še drugih bolezni. Seveda pa je treba vedeti, da razvoj novih zdravil, ki se začne z izbiranjem peščice ali le ene kandidatne molekule med milijoni spojin, traja vsaj poldrugo desetletje ali dlje in zahteva naložbo v višini poldruge milijarde evrov ...
Vsekakor pa po besedah sogovornikov tudi omenjena raziskava, ki so jo, opisano v članku ugodno ocenili mednarodno uveljavljeni recenzenti, »bogati področje razvoja zaviralcev imunoproteasoma, kar je zelo zanimiva tarča za razvoj novih zdravil«. Raziskovalci tako nadaljujejo razvoj novih zaviralcev, da bi še dodatno izboljšali delovanje molekul. Vložili pa so tudi evropsko patentno prijavo.
 Tiskane izdaje
Tiskane izdaje