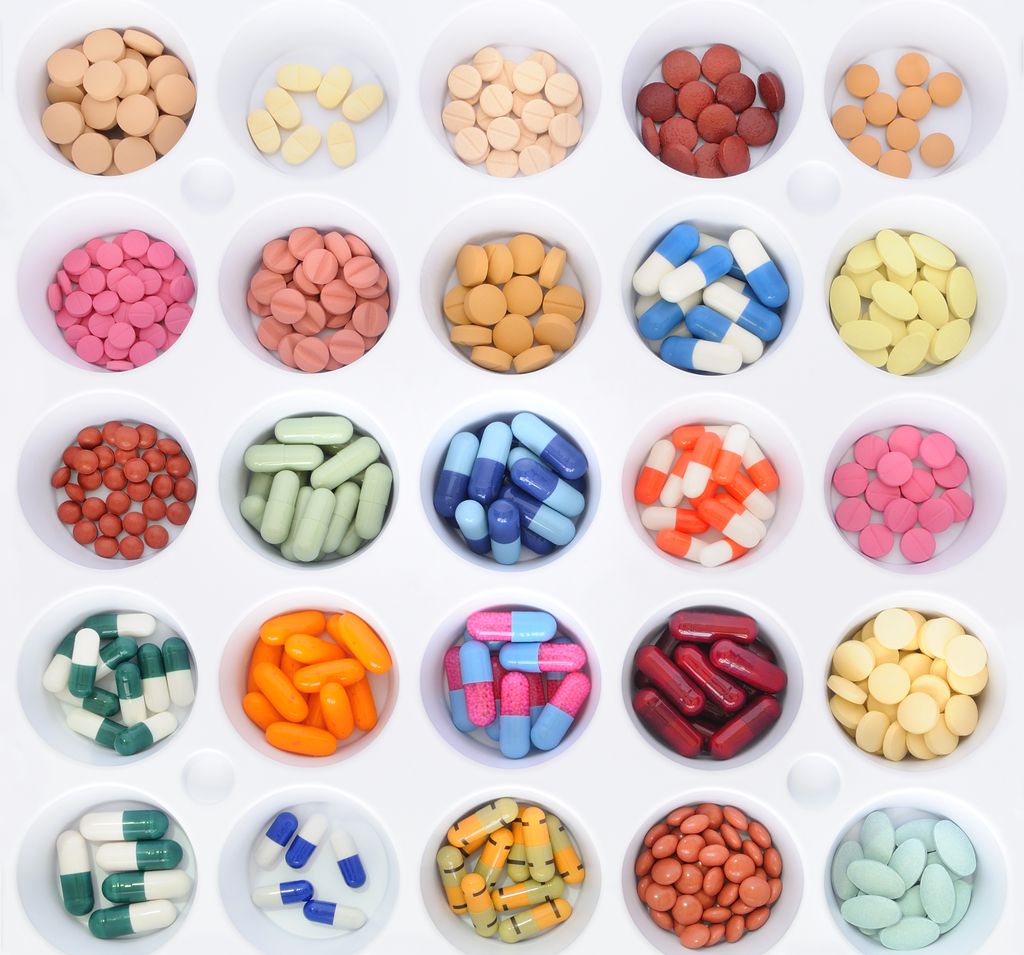
Tričetrt leta mineva v teh dneh od imenovanja dr. Andreje Čufar za direktorico Javne agencije za zdravila in medicinske pripomočke (JAZMP). Petletni mandat je že zdaj zapolnjen z zelo kompleksnimi izzivi, s katerimi se mora Slovenija spopasti, če hoče (p)ostati enakovreden akter v evropski in svetovni igri na področju zdravil, medicinskih pripomočkov, krvi, tkiv in celic – obolelim pa zagotoviti večjo varnost.
Na vseh področjih, ki jih pokriva JAZMP, so na ravni EU v pripravi številne spremembe; nekatere med njimi je treba vključiti v slovensko zakonodajo, medtem ko določene začnejo veljati neposredno po uveljavitvi v evropski regulativi.
Zdravila: nujne naložbe
To pa je pri nas problem. »Če Sloveniji informacijskih sistemov ne bo uspelo razviti dovolj zgodaj in dovolj kakovostno, pri vsem tem pomembnem dogajanju – pa naj gre za sodelovanje pri kliničnih študijah ali za spremljanje varnosti zdravil po tem, ko ta že imajo dovoljenje za promet – ne bi več mogla sodelovati. Da bomo lahko hodili vštric z razvitimi državami, bodo nujne naložbe v kadre, informacijsko tehnologijo in infrastrukturo,« poudarja sogovornica.
Znano je, da v Sloveniji informacijski sistem za zdravstvo še vedno ni in ne more biti primer dobre prakse, prej nasprotno. »Res, ta sistem bi pri nas moral delovati bolje, zato si mora država intenzivno prizadevati za izboljšave. Od dobre informacijske podpore je namreč zelo odvisna kakovost zdravljenja – pa tudi učinkovitost. Vemo, da so človeški viri v zdravstvu zelo omejeni. Če torej hočemo, da bodo naši zdravniki, medicinske sestre, farmacevti in vsi drugi strokovnjaki delali tako dobro, kot si naši zavarovanci oziroma bolniki zaslužijo in, seveda, tudi upravičeno pričakujejo, potem to zelo hitro lahko zagotovimo prav z dobro informacijsko podporo. In to je navsezadnje tudi bistveno hitreje kot čakanje na dodaten kader – če vemo, da izobraževanje vrhunskega strokovnjaka po končani srednji šoli traja več kot deset let,« meni direktorica JAZMP.
Primerjava z najrazvitejšimi področji v gospodarstvu – z zavarovalništvom, bančništvom ali s farmacevtsko industrijo – pokaže, da imajo vse te industrije vrhunsko informacijsko podporo. Andreja Čufar je zato prepričana, da mora zdravstvo temu slediti: »Nujno. Res nam ne bi smelo biti težko zagotoviti enotnega informacijskega sistema za zdravstvo, ki mora biti res odličen. Vsakdo med nami utemeljeno pričakuje najboljše zdravstvene storitve, kadar jih potrebuje – in to ne sme (p)ostati le želja.«

Dr. Andreja Čufar, direktorica Javne agencije za zdravila in medicinske pripomočke: "Država, ki ne bo imela učinkovitega nadzora, bo postala odlagališče za nekakovostne izdelke." Foto: Vornac Vogel/Delo
Resen zalogaj:
»Medicinski pripomočki so urejeni bistveno drugače kot zdravila, pri katerih pred prihodom na trg regulatorni organi preverijo njihovo kakovost, varnost, učinkovitost. Proizvajalec zdravila mora predložiti vso dokumentacijo, vključno z dokazili o učinkovanju zdravila, nato se začnejo postopki, za katere pri nas nemalokrat slišimo, da so preveč dolgotrajni. A so učinkoviti. Pri medicinskih pripomočkih pa tega ni, zato tudi njihova kakovost, varnost in učinkovitost niso vedno takšne, kot bi morale biti,« poudarja Čufarjeva.
Tudi po tem, ko zdravilo pride na trg, se preverjanje njegove varnosti ne konča – ta postopek je nekakšen perpetuum mobile, ki traja do konca, vse dokler zdravilo 'živi' in ostaja v obtoku. Klinične študije, ki so pri zdravilu prvi pogoj za pridobitev dovoljenja za promet namreč vključujejo omejeno število bolnikov – ko se začne bolj množična uporaba zdravila, se ti podatki spremenijo. Pojavnost in pogostnost neželenih učinkov pogosto svoj pravi obraz pokažeta šele čez čas – zato je stalni nadzor tako pomemben.
Pri medicinskih pripomočkih pa je praksa zelo drugačna, žal.
»Država imenuje organ, ki poskrbi, da proizvodnja poteka skladno z veljavnimi standardi, in je pristojen za odobritev uporabljanja oznake CE. Potem pa se rado zatakne – kajti to, ali pride na trg izdelek, ki izpolnjuje te standarde, je odvisno od (ne)odgovornosti proizvajalca,« opozori sogovornica.
Znani so, denimo, zapleti s silikonskimi vsadki za prsi, pri katerih je proizvajalec uporabljal nekakovosten material – silikon, ki sploh ni bil primeren za tovrstno uporabo –, zato so vsadki povzročali številne zaplete. Takrat so evropski organi začeli aktivnosti za spremembo zakonodaje – rezultat tega sta omenjeni uredbi.
»Njuna uveljavitev bo pripomogla, da bodo medicinski pripomočki, ki bodo naprodaj, varnejši, uporabniki pa bolj zaščiteni. To bo seveda prineslo veliko dodatnega dela, konkretno za JAZMP, ki je že zdaj zadolžena za nadzor trga, za spremljanje zapletov v zvezi z medicinskimi pripomočki in imenovanje priglašenega organa – to je Inštitut za kakovost in meroslovje. Konec maja smo imeli skupno presojo s predstavniki evropske komisije, zdaj pričakujemo, da bodo inštitut vpisali v bazo priglašenih organov na ravni EU; to pomeni, da bodo certifikati, ki jih odobri naš ESIQ, veljali na vseh trgih Unije,« pravi dr. Čufarjeva.
Med medicinske pripomočke spadajo zelo različni izdelki – od obližev, povojev, leč in tekočin za leče, umetnih kolkov, srčnih zaklopk pa vse do programske opreme, ki mora biti prilagojena fiziološkim ali patološkim parametrom vsakega posameznika, kot je, na primer, priprava za odmerjanje inzulina pri sladkornih bolnikih.
Problem je, ker v Sloveniji trenutno ni pregleda nad tovrstnimi pripomočki – razen nad tistimi, ki so izdelani pri nas. V mednarodni bazi podatkov je sicer mogoče preveriti, ali so uvoženi pripomočki tam vpisani ali ne – ni pa celovitega pregleda nad tem, kaj sploh prihaja na slovenski trg.
»To bo treba narediti, nujno, kajti le z bistveno doslednejšim nadzorom trga bomo lahko izboljšali varnost uporabnikov – pacientov. Na JAZMP imamo trenutno le eno inšpektorico za medicinske pripomočke, zato bodo kadrovske okrepitve nujne. Ministrstvu za zdravje smo že predlagali povečanje števila inšpektorjev, upamo, da bo vlada to potrdila. Jasno je, da bo mrežo treba širiti postopno, a vztrajno – zato leta 2017 želimo imeti vsaj štiri inšpektorje. Ta kvota pa je nujna, če želimo zagotoviti nadzor trga, če hočemo poskrbeti za varnost prebivalstva. Kajti vsaka država, ki ne bo imela učinkovitega nadzora, bo postala odlagališče za nekakovostne izdelke – če se zelo milo izrazim,« opozarja sogovornica.
Slovenski trg je majhen. Logično je, da veliki proizvajalci oziroma preverjeno kakovostni akterji na tem področju za takšne trge niso zainteresirani – država je tista, ki si mora prizadevati za spremembo stanja, ki je zdaj vse prej kot optimalno.
Medtem ko pri zdravilih pred prihodom na trg regulatorni organi preverijo njihovo kakovost, varnost, učinkovitost, nadzora med medicinskimi pripomočki pri nas ni; izjema so izdelki, narejeni v Sloveniji. Foto: Shutterstock
Absolutna novost:
To so tkivne oziroma celične kulture v širšem pomenu besede. »Ta biološka celična zdravila v zdravstvenem sistemu – v kliničnih ustanovah, specializiranih za specifična zdravljenja praviloma genetsko pogojenih bolezni – pripravljajo individualno, unikatno. Vsak odmerek za vsakega pacienta je inovativen in unikaten. Priprava zdravila, ki ga sintetizirajo iz različnih gradnikov bolnikovega organizma namreč ni rutinska, kot denimo pri bioloških ali podobnih bioloških zdravilih,« pojasnjuje direktorica JAZMP.
Inšpektorji agencije za zdravila preverjajo izvajalce, ki pripravljajo ta zdravila, njihov sistem zagotavljanja kakovosti in skrbi za varnost bolnikov.
»Ko sem študirala farmacijo, je bila to znanstvena fantastika – zdaj je to nekaj, kar se že dogaja. Država bi morala skrbeti, da je za taka znanja in aktivnosti zagotovljen denar – kajti če tega ne bomo sami zagotovili svojim državljanom, je vprašanje, kam in za kakšno ceno bodo ti lahko odhajali na tovrstno zdravljenje. Ta možnost je zelo dragocena, zato je res ne smemo izgubiti,« dodaja doktorica, ki sicer verjame v fenomenalnost slovenske države. Zakaj?
»Po številu vrhunskih športnikov na število prebivalcev smo gotovo najboljši – in mislim, da smo prav tako dobri tudi na katerem drugem področju. To premalo poudarjamo, premalo cenimo – predvsem pa si moramo prizadevati, da to ohranimo. Tudi zaradi vseh izzivov, ki Slovenijo čakajo na mednarodni ravni.«
Med njimi Andreja Čufar poudarja globalne sporazume, ki jih Evropa sklepa s Kanado, z ZDA in so pomembni z vidika medsebojnega priznavanja inšpekcijskih organov: »Slovenskemu gospodarstvu moramo zagotavljati res vrhunsko podporo, zato se trudimo, da nas bodo priznavale tudi druge agencije razvitih držav, denimo ameriški urad za hrano in zdravila FDA.«
V JAZMP tako že prihodnje leto pričakujejo eno od mednarodnih presoj, v sklopu katere bodo tuji ocenjevalci pregledali, kako dobra je v resnici slovenska inšpekcija na področju zdravil.
 Tiskane izdaje
Tiskane izdaje