Zarodek resda ni imel nikakršne možnosti preživetja, a je Huangov poseg v njegovo DNK vendarle na stežaj odprl vrata bojaznim, da bi lahko tehniko CRISPR že v razmeroma skromnem laboratoriju kjerkoli na svetu zlorabili, posledice pa bi občutili poznejši rodovi.
Tehnika CRISPR, ki ji revija Science za letos napoveduje silovit razmah, je nadvse obetavna. Tako je na primer pred kratkim raziskovalcem s kalifornijskih univerz v Irvinu in San Diegu uspelo s to tehniko vzgojiti gensko prirejene komarje, ki so v nasprotju s komarji, prenašalci malarije, spremenjeni tako, da jih parazit malarije ne more okužiti, to lastnost pa lahko v kar 97 odstotkih podedujejo tudi njihovi potomci. Na podoben način bi se lahko verjetno poskušali znebiti še drugih bolezni, ki jih prenašajo komarji in muhe, na primer vročice denga, ki se je z globalnim segrevanjem začela širiti iz tropskih predelov na druga območja našega planeta.
Vendar tema pogovorov več sto genetikov, biologov, filozofov in načrtovalcev raziskovalne politike, ki so se pred koncem leta zbrali na tridnevni konferenci o tej tehniki v Washingtonu, niso bile čestitke za omenjeni dosežek. Nasprotno, razprava se je osredotočila le na etičnost uporabe te obetavne, a zelo polemične tehnologije na človeških zarodkih. Razvnemale so jo predvsem lastnosti, zaradi katerih se ta tehnika razlikuje od drugih tehnik genskega inženiringa – in sicer enostavnost, učinkovitost in nizka cena. Po drugi strani pa so bili na srečanju navzoči tudi svojci bolnikov z usodnimi dednimi boleznimi, ki so raziskovalce spodbujali k čimprejšnji uporabi omenjene tehnologije za zdravljenje bolezni.
Relativna preprostost uporabe te tehnologije naj nikakor ne bi prerasla v lahkotnost odločanja, kaj z njo početi. Njeni učinki namreč ne ostanejo le v ciljnih organizmih, ampak se dedujejo, z njimi pa tudi morebitne napake, ki se lahko pojavijo pri modifikacijah s pomočjo CRISPR v genomu. CRISPR torej omogoča spremembe same DNK, in tu lahkotnost njene uporabe ob soočenju s silnim bremenom odgovornosti postane zastrašujoča.
Posnemanje bakterij
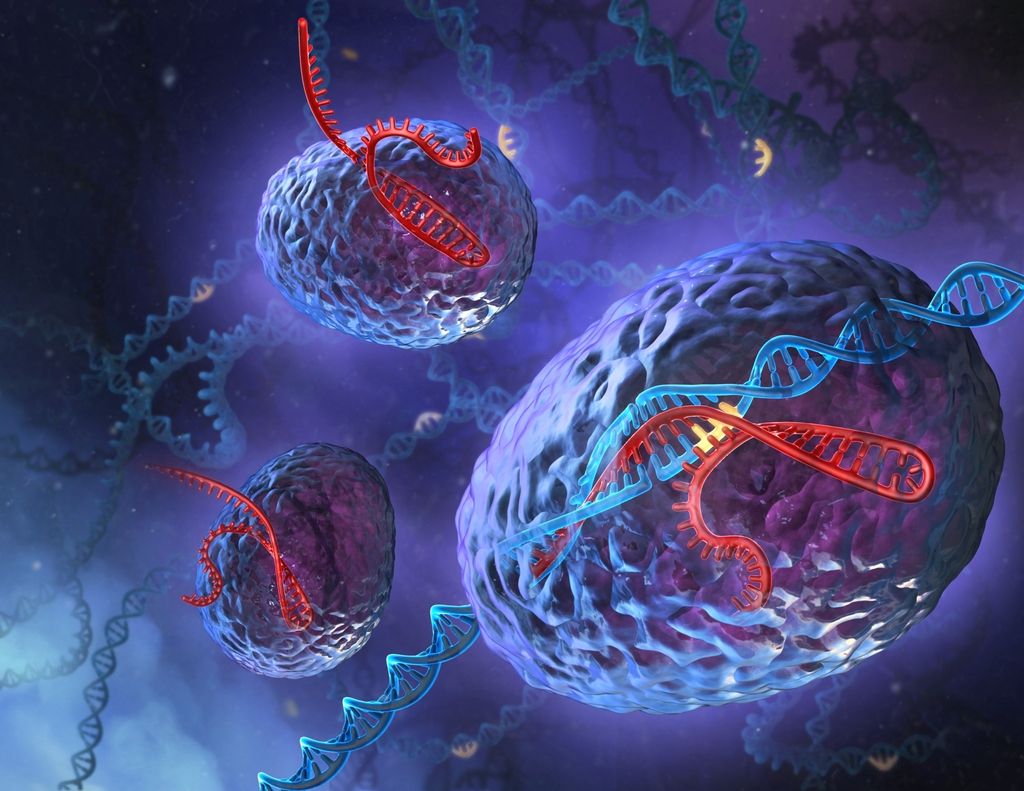
Kakšna je pravzaprav ta tehnika? Čeprav jo odlikuje preprostost, to še ne pomeni, da jo je tudi preprosto razumeti. CRISPR je kratica za skupke kratkih palindromskih ponovitev v pravilnih presledkih, ki so jih najprej opazili pri bakterijah – te se z njimi branijo pred okužbo virusov. Delovanje sistema CRISPR je sestavljeno iz dveh delov: majhnega dela RNK in proteina Cas9. Ta je encim, ki razreže DNK, in sicer na mestu, kamor ga usmeri kratka veriga RNK.
CRISPR-Cas9 je torej del bakterijskega imunskega sistema, ki ga je mogoče sprogramirati tako, da na točno določenem mestu v genomu razreže točno določeno gensko zaporedje, in to, če je treba, na več mestih hkrati. Če celici hkrati ponudimo še ustrezen nadomestek za uničeno DNK, dobimo gensko spremenjeno celico po svojem okusu.
Preden znanstveniki vbrizgajo CRISPR v celico, najprej programirajo RNK tako, da ustreza kodi določenega gena v DNK celice, ki jo želijo spremeniti. RNK, ki se veže na Cas9, tega vodi do določenega zaporedja v genomu, kjer Cas9 prevzame funkcijo škarij in na tistem mestu prereže obe verigi DNK. Celica hoče poškodbo takoj popraviti, zato na tem mestu pride do skrajšanja DNA in inaktivacije izbranega tarčnega gena ali do nadomestitve z zaporedjem DNK, ki ga sočasno vnesemo v celico.
Kompleks torej zazna sporni gen in ga po principu »kopiraj-prilepi« takoj popravi ali zamenja z drugo molekulo. Ta sistem raziskovalci že precej uporabljajo pri raziskavah celic živalskih zarodkov, prvi pa ga je letos na človeškem zarodku, sestavljenem le iz nekaj celic in nesposobnem preživetja, uporabil Huang Junjiu na Kitajskem. Čeprav je bil njegov namen raziskati možnost, kako odpraviti hudo gensko napako, ki povzroča razvoj potencialno smrtne bolezni (betatalasemije), je zaradi premalo raziskane varnosti in etičnosti »popravljanja« embrijev izzval glasne pomisleke.
Avtorji so za svoje raziskave dobili odobritev etične komisije na univerzi Sun Yat-sen, vendar sta objavo članka o tem poskusu zavrnili tako revija Nature kot revija Science. Zelo hitro so ga zato objavili v precej manj ugledni reviji, ker so se novice o raziskavi kljub zaupnosti recenzij hitro razširile. Avtorji so sicer v članku ugotovili, da sedanja tehnika še ni dovolj zanesljiva za uporabo pri genski terapiji.
Svetovni moratorij
Klinični preizkusi novih medicinskih posegov na ljudeh so sicer v ZDA, Evropi in še nekaterih državah natančno zakonsko urejeni. Toda ponekod so pravila precej manj stroga, zato je podpisnike poziva za moratorij zaskrbelo, da se ne bi prav tam zaradi dostopnosti, učinkovitosti in cenenosti tehnike lotili poskusov na ljudeh, preden bi bilo razčiščeno, kaj takšni posegi pomenijo. Zato so se zavzeli, da bi moratorij za te posege veljal po vsem svetu, vse dokler ne bi oblikovali in sprejeli javno znanih etičnih standardov glede uporabe te tehnike.
CRISPR-Cas9 sicer res obeta učinkovito zdravljenje genskih bolezni, vendar ga je mogoče uporabiti tudi v druge, sporne namene, na primer v lepotne ali v povečevanje inteligence. Ker se ti posegi v gene, kot rečeno, podedujejo, tehnika omogoča vplivanje na prihodnje generacije. Takšen vpliv pa bi moral biti po mnenju podpisnikov poziva zelo odgovoren in v skladu z visoko postavljenimi etičnimi standardi.
Kljub večji učinkovitosti od drugih genskih tehnik pa tudi CRISPR ni popoln, saj še zdaleč ne deluje vedno in brez napak. Občasno lahko sproži spremembe v genih, kakršnih znanstveniki niso načrtovali. Zato se mnogi kljub strinjanju s pomisleki o etičnosti uporabe metode pri človeških zarodkih zavzemajo za strogo regulirane nadaljnje raziskave. Te bodo morda tehniko še izboljšale in raziskovalce približale trenutku, ko bi lahko varno odpravili razne poškodbe DNK in z njimi povezane bolezni, od cistične fibroze do srpastocelične anemije, hemofilije in verjetno tudi mišične distrofije.
Pred dnevi so sicer objavili rezultat uspešnega zdravljenja mišične distrofije na odraslih miših s tehnologijo CRISPR. Pravzaprav bi lahko, teoretično gledano, odpravili vsako dedno bolezen, kakor hitro bi ugotovil, katera mutacija genov jo povzroča. Tehnologija CRISPR bi nato te mutirane gene izsledila, jih izrezala in nadomestila z nepoškodovano verzijo.
Zrela tehnika za zrelo družbo
Druga smer raziskav meri na izboljšanje genov, ki sicer niso poškodovani, a bi njihove spremembe lahko izboljšale učinkovitost organizma. Recimo, z majhnimi spremembami genov v poljščinah in pri živini bi lahko ustvarili rastline, ki za rast potrebujejo manj vode, ali pa krave, ki bi imele več mesa, ne da bi za to potrebovale več krme.
Pri omenjenih posegih se znajdemo pred pomembno dilemo, namreč, ali organizme, nastale s pomočjo omenjene tehnologije, uvrščamo med gensko spremenjene ali ne. Do natanko enakih sprememb je namreč mogoče priti tudi z naključnimi mutacijami, za katere pa bi bila morda potrebna desetletja.
Vsi ti dosežki bi lahko izjemno koristili človeštvu. Kako torej rešiti dilemo o upravičenosti moratorija na uporabo tehnike na ljudeh in o potrebi po nadaljnjih raziskavah? Na znanstveni konferenci v Washingtonu so se po burni razpravi zavzeli za nadaljnje raziskave tudi na embrijih, odločno pa so bili proti kakršnikoli klinični uporabi te tehnike.
»Tehnologija za klinično uporabo še ni zrela, ker družba še ni zrela,« se glasi sklep konference. Toda tehnologija je že tu. Od zrelosti družbe bo torej odvisno, ali bo nasvet konference upoštevala ali ne.
Domači odziv
Tehniko CRISPR že dve leti uporabljajo tudi znanstveniki v Sloveniji. Kaj bo leto 2016 prineslo v uporabi te
tehnike? Bo mogoče preprečiti zlorabe in hkrati dopustiti nadaljnje raziskave, smo vprašali prof. dr. Romana Jeralo, ki na Kemijskem inštitutu v Ljubljani vodi laboratorij za biotehnologijo.
»Pri nas smo tehnologijo CRISPR začeli uporabljati zelo kmalu po tem, ko se je pokazala njena uporabnost za delo s celicami sesalcev, in že lani bi si tehnologija zaslužila naziv najpomembnejšega znanstvenega preboja. Zagotovo bomo v letošnjem letu priča številnim izboljšavam tehnologije in novim načinom uporabe,« meni dr. Jerala in dodaja:
»V naši skupini nas zanimajo predvsem možnosti terapevtske uporabe, pri kateri ne spreminjamo genoma, ki prinaša precejšnje tveganje. Cas9 namreč lahko uporabimo tudi za uravnavanje izražanja izbranih genov. V tem vidimo velike možnosti zdravljenja; zlasti nas zanimajo vnetne bolezni, diabetes in rak.«
»Ne dvomim, da se bo tehnologija morda že v petih letih začela uporabljati v medicini. Najprej zagotovo za spreminjanje izoliranih celic iz pacientov, torej s spremembami, ki ne bodo dedne. Treba pa je omeniti, da obstaja še veliko drugih, manj tveganih možnosti, da preprečimo dedne bolezni – z genskim svetovanjem ali, na primer, z analizo embrijev po umetni oploditvi. Pri teh, manj tveganih možnostih bi lahko izbrali tiste, ki ne vsebujejo bolezni povzročujočih mutacij.«
 Tiskane izdaje
Tiskane izdaje