Sodobne biomedicinske raziskave so že razkrile številne poti in načine sporazumevanja med milijardami celic v zdravem človekovem organizmu in med boleznijo. Niso pa še jasni vsi mehanizmi, povezani z nastankom raka, njegovim širjenjem in odpornostjo rakavih celic. Pomemben prispevek k razumevanju teh procesov so dodali raziskovalci Kemijskega inštituta v Ljubljani z odkritjem, da zunajcelični vezikli, ki jih sproščajo rakave celice, vsebujejo signalni posrednik (MyD88), ki se lahko prenese v okoliške celice, jih aktivira in tako spreminja svoje okolje.
Celice se odzivajo na spremembe v okolju prek prenosa signalov z aktivacijo receptorjev, ki sprožijo različne procese, na primer vnetni odziv pri različnih okužbah in poškodbah; zaradi vnetja, ki ga izzove kakšen tujek, »prebujen« imunski odziv najpogosteje ubrani telo pred boleznijo. Kadar pa tak odziv uide izpod nadzora, lahko to poganja kronične in tudi rakave bolezni.
Da zunajcelični vezikli prenašajo signale in tako posredujejo komunikacijo med celicami, je predmet intenzivnih raziskav v zadnjih letih. Zdaj so raziskovalci dokazali, da lahko zunajcelični vezikli prenašajo tudi celotne aktivne signalne komplekse, ki v tem primeru vsebujejo beljakovino MyD88, in se s tem izognejo klasični poti aktivacije prek receptorjev.
Posebnost B-celičnega limfoma
Zanimiv primer pretirane aktivacije celic, ki spodbuja raka, je Waldenströmova makroglobulinemija (WM), vrsta limfoma, pri katerem so odkrili, da ima več kot 90 odstotkov bolnikov mutirano beljakovino MyD88. Posledica je, da je ta beljakovina ves čas aktivna, in to neodvisno od receptorjev, zato poganja vnetje. Drugi so že pokazali, da če se blokira signalizacija prek omenjene beljakovine, to povzroči smrt rakavih celic.
»Dr. Monika Avbelj, nekdanja sodelavka v našem laboratoriju, danes zaposlena v Leku, je pred leti raziskovala mutacijo L265P na beljakovini MyD88. Molekulski mehanizem delovanja mutirane oblike MyD88 so pojasnili in o njem poročali v znanstveni literaturi,« razlaga dr. Mateja Manček Keber, višja znanstvena sodelavka na odseku Kemijskega inštituta za sintezno biologijo in imunologijo.
Sogovornica je prva avtorica najnovejše raziskave o odkritju prenosa signalnih kompleksov iz rakavih celic z zunajceličnimi vezikli. Rezultati raziskave so bili pred dnevi objavljeni v reviji Blood, eni vodilnih publikacij za hematologijo s faktorjem vpliva 13,1. Avtorji so še Duško Lainšček in Mojca Benčina s Kemijskega inštituta, Rok Romih z Inštituta za biologijo celic pri Medicinski fakulteti Univerze v Ljubljani, Jiaji G. Chen, Zachary R. Hunter in Steven P. Treon z Inštituta za raziskave raka Dana-Farber pri harvardski medicinski fakulteti, enega najuglednejših centrov za zdravljenje te vrste raka na svetu, ter Roman Jerala s Kemijskega inštituta, ki je raziskavo vodil.
Samodejni prožilec imunskega odgovora
Mateja Manček Keber se sicer že vrsto let ukvarja s tako imenovanimi »toli«: v stroki so znani po oznakah TLR (Toll-like receptors). To so membranski receptorji, ki prepoznavajo različne sestavine mikroorganizmov in sprožijo imunski odziv. Ležijo bodisi na površini celice bodisi v posebnih organelih v notranjosti, za prenos signalov v jedro po aktivaciji receptorjev TLR pa je zelo pomembna omenjena beljakovina MyD88.
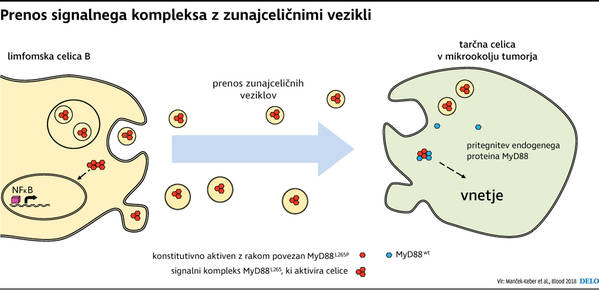
»Znanje, ki smo ga pridobili iz prejšnjih raziskav, nam je pomagalo razumeti, zakaj mutirana beljakovina MyD88 lahko sproži vnetje, ne da bi se prej aktivirali receptorji TLR. Se pravi, da tudi ko ni okužbe in ne liganda za omenjene receptorje, bo mutirana beljakovina aktivna in bo nenehno sprožala vnetje ter imunski odziv. S tem očitno ustvarja pogoje, ki vplivajo na razvoj raka,« pojasnjuje sogovornica.
Kot dodaja, so že dlje časa znana opažanja, da kronično, stalno vnetje v telesu morda res ni glavni vzrok za razvoj raka, je pa zelo verjetno pomembno pri razvoju raka, za metastaziranje in druge procese, ki se dogajajo v organizmu. »Vsi ti mehanizmi še niso povsem jasni, gotovo pa ima stalni stres za organizem številne neprijetne posledice.«
Morebiti usodna
Značilen primer avtoimunskih bolezni je revmatoidni artritis. Kot razlaga Manček Kebrova, so tako že pred leti sodelovali s kliničnimi zdravniki v bolnišnici dr. Petra Držaja v Ljubljani. Skupaj so pokazali povečane količine zunajceličnih veziklov v vzorcih krvi in sinovijske tekočine pri teh bolnikih. Ugotovili so, da lahko zunajcelični vezikli, ki se sproščajo iz celic zaradi oksidativnega stresa, aktivirajo receptor TLR4, kar sproži vnetje in lahko poganja kronično vnetje pri teh boleznih.
»Ker sem imela znanje o zunajceličnih veziklih, sem na predlog vodje odseka prof. dr. Romana Jerale pripravila raziskovalni projekt, s katerim smo se odločili združiti to znanje z znanjem, pridobljenim z raziskovanjem delovanja mutiranega MyD88. Mutirana beljakovina MyD88 namreč pridobi dodatne lastnosti, na primer to, da spontano tvori agregate, kar poveča verjetnost, da bi se lahko prenesla v vezikle. Že prvi preliminarni poskusi so nakazali, da bi to res lahko držalo, zato smo zgrabili priložnost.«
Potovanja veziklov
Zunajcelični vezikli so zelo majhni mehurčki; večji, ki se ponavadi sprostijo s površine celic, merijo približno en mikrometer, manjši, ki nastajajo v notranjosti in se nato sprostijo v okolje, so eksosomi, veliki okoli 100 nanometrov. Obdani so z lipidno membrano in vsebujejo sestavine celic, kot so beljakovine, oligosaharidi, lipidi in molekule RNK. Potujejo po krvi in najdemo jih v vseh telesnih tekočinah. Pomembni so za prenos informacij med izvornimi in tarčnimi celicami ter, kot so pokazale raziskave, tudi pri širjenju raka. S preoblikovanjem zunajceličnega matriksa sodelujejo pri nastanku niš, ki so ugodne za metastaziranje.
Ključno sodelovanje
Izolirali so vezikle iz aspiratov kostnega mozga bolnikov z WM in pokazali, da je v njih beljakovina MyD88. Tako so smiselno in uporabno združili bazično in klinično raziskovalno delo in s tem povečali vrednost rezultatov.
»Čeprav je začetno, formalno za dve leti načrtovano sodelovanje končano, seveda upamo, da bomo tak način dela na skupnih projektih nadaljevali. Načrtujemo, da bomo še bolj poudarjeno raziskovali, kako se širijo rakaste celice po organizmu in kako zunajcelični vezikli vplivajo na to,« pravi sogovornica.
Seveda se postavlja vprašanje, kdaj in kako bi lahko – po možnosti čim hitreje – nova temeljna spoznanja uporabili za razvoj novih zdravil, nove postopke zdravljenja, izboljšanje klinične prakse. Kot pravi sogovornica, bo treba do klinično uporabnih rezultatov opraviti še precej korakov, čeprav raziskave, kako ustaviti sproščanje in prevzemanje zunajceličnih veziklov, že potekajo in čeprav so že pokazali, kako z inhibiranjem prevzemanja lahko upočasnijo napredovanje tumorjev. »Pomemben je vsak uspeh na tej poti,« poudarja Mateja Manček Keber.
 Tiskane izdaje
Tiskane izdaje