V osemdesetih letih, ko je bila razkrita ultrastruktura celic, se je na področju ved o življenju končevalo obdobje opisne elektronske mikroskopije. Nov razcvet je elektronska mikroskopija doživela z uvajanjem kriometod.
S pojmom kriometode v elektronski mikroskopiji opisujemo metode, ki v celoti (na primer krioelektronska mikroskopija) ali le v nekaterih korakih (na primer kriofiksacija) potekajo pri temperaturah pod –100 stopinj Celzija. Rezultati kriometod nam dajejo vpogled v 'sociologijo' celic – kompleksnih medsebojnih odnosov med molekulami in drugimi celičnimi strukturami. To omogoča razumevanje normalnega in patološkega delovanja celic, tkiv, organov in organizmov ter pripomore k razvoju novih postopkov zdravljenja.
Milijonkratne povečave
Glavna prednost elektronske mikroskopije pred drugimi slikovnimi tehnikami je velika ločljivost. Novi elektronski mikroskopi dosegajo ločljivosti nekaj stotink nanometra (vodikov atom ima premer približno desetinko nanometra) in milijonkratne povečave. Da bi lahko izkoristili tehnične zmogljivosti elektronskih mikroskopov, biološki vzorci zaradi svojih specifičnih lastnosti zahtevajo zapletene postopke priprave.
Vzorci so v elektronskih mikroskopih v visokem vakuumu, kjer so izpostavljeni curku pospešenih elektronov. Opazovanje živih celic zato ni mogoče. Prvi in ključni korak k pripravi bioloških vzorcev je fiksacija, postopek, s katerim ustavimo življenjske procese in stabiliziramo strukture celic. Za kemijsko fiksacijo najpogosteje uporabljamo aldehide in osmijev tetroksid, ki vzorce fiksirajo razmeroma počasi, zato nastajajo neželene spremembe v ultrastrukturi celic. Hkrati s kemijsko fiksacijo vnašamo snovi, ki spremenijo kemijsko sestavo bioloških vzorcev.
Z razvojem biokemije in molekularne biologije je postalo nujno 'videti in verjeti', kje so v intaktnih celicah molekule in kakšne so interakcije v kompleksnem celičnem okolju.
Kako ohraniti ultrastrukturo
Za uspešno analizo korelacije med strukturo in funkcijo moramo čim bolje ohraniti ultrastrukturo, antigenske lastnosti proteinov in lokacije molekul. Edina možnost, ki izpolnjuje te pogoje, je kriofiksacija, hitra zamrznitev bioloških vzorcev na temperaturo manj kot –100 stopinj Celzija. Med kriofiksacijo se ne smejo tvoriti vodni kristali, ki bi poškodovali strukture. Postopku, pri katerem nastane amorfen led, pravimo vitrifikacija. Uspešnost vitrifikacije je odvisna od velikosti vzorca in naprav, ki jih uporabljamo.
Na inštitutu za biologijo celice uporabljamo napravo, ki omogoča vitrifikacijo vzorcev samo do debeline deset mikrometrov (en mikrometer je tisočinka milimetra), to pa je približen premer ene celice. Vitrifikacijo večjih vzorcev zagotavlja samo naprava za kriofiksacijo pri visokem tlaku. Ta pri tlaku okoli 2000 atmosfer vzorce ohladi do temperature –150 stopinj Celzija v manj kot petih milisekundah, zato voda »nima časa« za tvorbo kristalov. Te aparature pa v Sloveniji nimamo.
Krioelektronska mikroskopija vodilna
Za dosežke pri razvoju krioelektronske mikroskopije so Nobelovo nagrado za kemijo letos prejeli Joachim Frank, Richard Henderson in Jacques Dubochet. Znanstveniki z inštituta Maxa Plancka so pred kratkim naredili še korak naprej: s fokusiranim ionskim snopom v vrstičnem krioelektronskem mikroskopu iz vitrificiranih celic izrezujejo od 150 do 300 nanometrov debele rezine, ki jih nato analizirajo v presevnem krioelektronskem mikroskopu. Rezultati te metode, imenovane strukturna biologija in situ, pokažejo delovanje molekulskih motorjev v širšem celičnem kontekstu in že prinašajo nova spoznanja o nevrodegenerativnih boleznih.
Kriometode pri nas
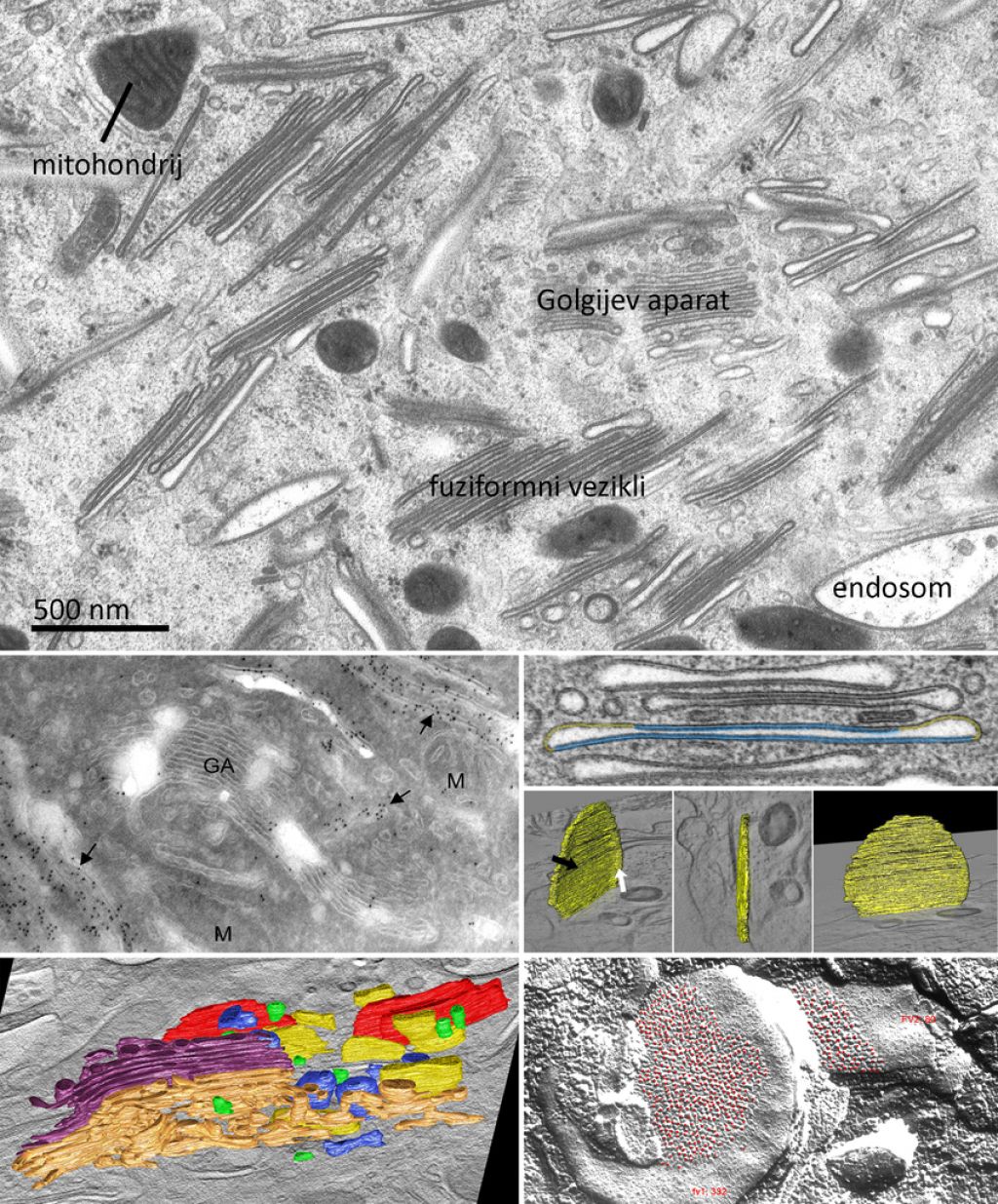
K novemu pogledu na ultrastrukturo celic je v zadnjih dvajsetih letih največ pripomogla elektronska tomografija. Temeljni princip elektronske tomografije je slikanje vzorca pod različnimi koti v elektronskem mikroskopu. Temu sledi obdelava slik z računalniškimi algoritmi, ki naredijo obratno projekcijo in iz nje tridimenzionalno rekonstrukcijo vzorca.
Za izvedbo elektronske tomografije potrebujemo namenski presevni elektronski mikroskop in aparaturo za kriofiksacijo pri visokem tlaku. Ker v Sloveniji te raziskovalne opreme nimamo, smo se raziskovalci inštituta za biologijo celice, vključeni v raziskovalni program Diferenciacija urotelijskih celic (sofinancira ga javna agencija za raziskovalno dejavnost iz državnega proračuna), dogovorili za sodelovanje z dunajsko medicinsko fakulteto. Z elektronsko tomografijo celic epitelija sečnega mehurja smo pojasnili, kako se vzpostavi pregrada med urinom in krvnim obtokom v zdravem sečnem mehurju in kako se med razvojem nekaterih bolezni spremenijo organeli, ki pri tem sodelujejo.
Za študij celičnobioloških procesov smo na inštitutu uvedli dve kriometodi za detekcijo in lokalizacijo proteinov na ultrastrukturni ravni. Prva je imunooznačevanje krioultratankih rezin in druga imunooznačevanje replik po zamrzovalnem lomljenju. Metodama je skupno, da v celice ne vnašamo snovi, ki bi spremenile sestavo proteinov, zato te lahko uspešno označujemo s protitelesi.
Pri prvi metodi zamrznjene vzorce narežemo na debelino 50 nanometrov pri temperaturah, nižjih od –120 stopinj Celzija, za kar uporabljamo ultrakriomikrotom. Rezine poberemo na nosilce za presevni elektronski mikroskop ter jih inkubiramo s protitelesi, ki se vežejo na iskane proteine.
Pri metodi imunooznačevanja replik po zamrzovalnem lomljenju zamrznjene vzorce vstavimo v komoro s temperaturo –150 stopinj Celzija in visokim vakuumom (10–8 atmosfere)
Neuspešna bitka za naprave
Kriometode, ki so v 21. stoletju postale nenadomestljive v celični biologiji in medicini, zahtevajo razmeroma drago raziskovalno opremo. Zaradi kronične finančne podhranjenosti raziskovalne dejavnosti pri nas ne moremo obnavljati zastarele in izrabljene infrastrukture. Še manj smo sposobni realizirati nakup inovativne opreme, s katero bi se lahko postavili ob bok naprednim državam. Precej bridka resnica je, da si že več let neuspešno prizadevamo za denarna sredstva, s katerimi bi dobili raziskovalno eksistenčno nujno napravo za kriofiksacijo pri visokem tlaku. Napravo bi lahko uporabljal širši krog raziskovalcev v Sloveniji, ne le naš inštitut. Ledene dobe na Zemlji so večinoma povzročale zastoj evolucijskih procesov. Prav nasprotno se je zgodilo v elektronski mikroskopiji. Postopki, ki lahko potekajo samo pri temperaturah globoko pod lediščem, so pripomogli k njenemu neslutenemu razcvetu. Le tam seveda, kjer je bilo okolje res ozaveščeno o dolgoročno velikem potencialu znanosti.
Ledena doba elektronske mikroskopije
Kriometode v elektronski mikroskopiji omogočajo opazovanje življenjskih procesov, ujetih v delčku sekunde
Objavljeno
17. december 2017 13.00
Posodobljeno
17. december 2017 13.00
Pridobljeni rezultati strukturne biologije in situ že prinašajo nova spoznanja o nevrodegenerativnih boleznih.
 Tiskane izdaje
Tiskane izdaje