Zaporedje določijo v eni uri, stane približno tisoč dolarjev, pomaga pri zdravljenju bolnikov z rakom.
Britanski znanstvenik na področju sintezne biologije in nanobiotehnologije dr. Hagan Bayley, profesor kemijske biologije na Univerzi v Oxfordu, je bil prejšnji teden gost Preglovega kolokvija na Kemijskem inštitutu v Ljubljani. V predavanju Protein Pores as Nanoreactors for Single-molecule Covalenet Chemistry je predstavil pristope, ki jih razvijajo pri uporabi proteinskih nanopor.
»Kako lahko membranske proteine uporabljamo v biotehnologiji, je osrednji del mojega predavanja. Uporabljamo jih lahko kot neke vrste reaktorje, da ugotovimo, kako se obnašajo druge molekule in na kakšen način potekajo določene kemijske reakcije. S to tehniko opazujemo kemijske reakcije posameznih molekul,« je na kratko povzel bistvo predavanja prof. dr. Hagan Bayley.
V Ljubljano ga je povabil prof. dr. Gregor Anderluh, vodja laboratorija za molekularno biologijo in nanobiotehnologijo na Kemijskem inštitutu. Laboratorij namreč sodeluje z nanobiotehnološkim podjetjem Oxford Nanopore Technologies, ki ga je leta 2005 ustanovil prof. Bayley, pri raziskavah zgradbe in delovanja novih nanopor ožigalkarjev in drugih organizmov.
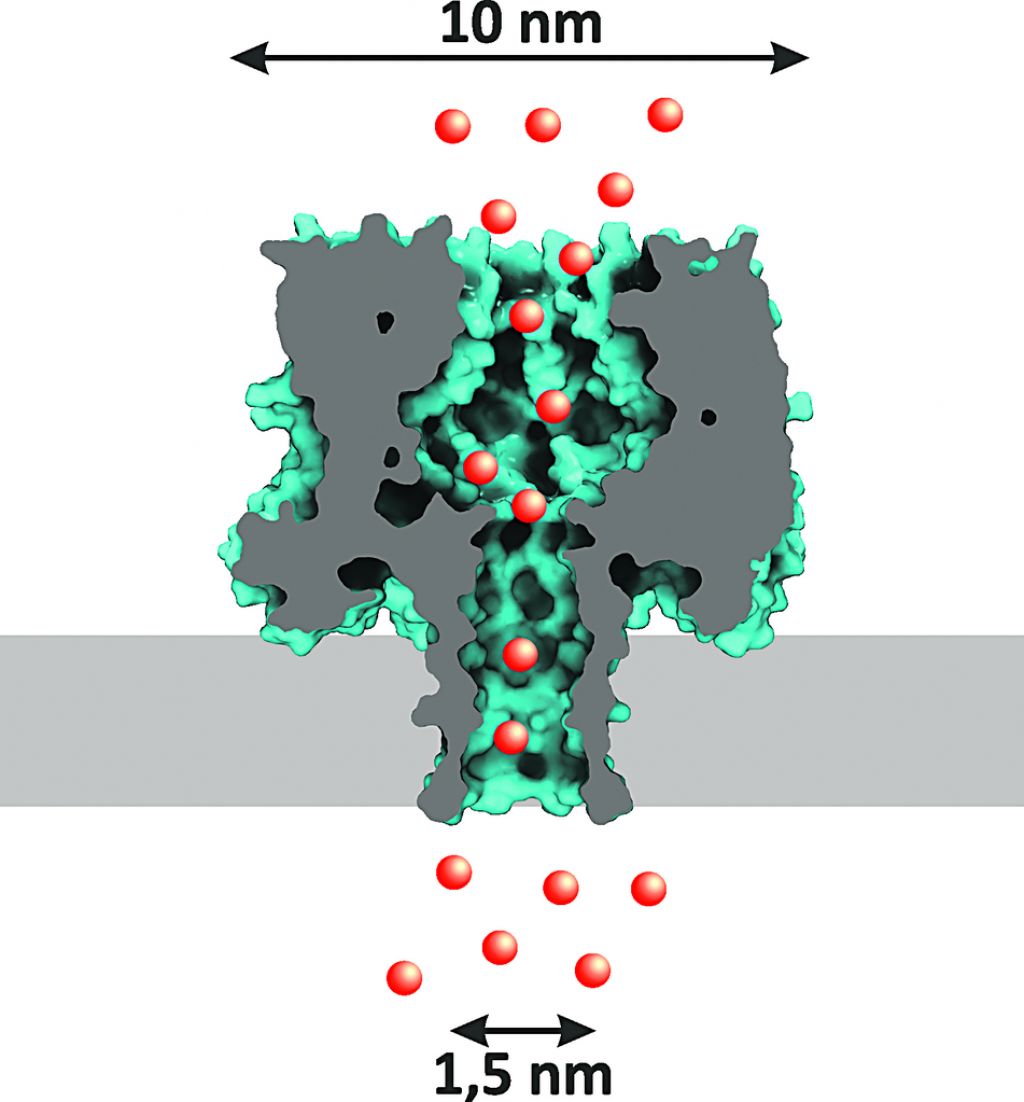
Biološke nanopore imajo pred porami v sintetičnih materialih velike prednosti, ker se da na njihove lastnosti vplivati s kemijskimi ali genetskimi spremembami. Zato se velika pozornost namenja iskanju novih bioloških proteinskih nanopor, ki bi bile uporabne za različne namene v senzorskih aplikacijah, na primer pri zaznavanju proteinov, DNK, RNK ali drugih molekul.
Prof. Bayley, katere raziskave ste opravili prej, preden ste se osredotočili na nanopore?
Že pred več kot 25 leti me je začelo zanimati, kako se oblikujejo membranski proteini v celici. V prvih raziskavah smo uporabili preprost model sistema bakterijskega proteina, in sicer alfatoksina, ki ga izloča bakterija Staphylococcus aureus. To bakterijo najdemo pri zastrupitvah s hrano in v bolnišnicah, znano kot MRSA.
Celične membrane so zelo hidrofobne, kar zelo poenostavljeno pomeni, da so mastne in tako lahko držijo stvari zunaj in znotraj celic. Hkrati pa je treba prenašati molekule skozi celične membrane, zato je delovanje proteinov v membranah zelo pomembno.
Pri svojem delu smo uporabili preprost modelni sistem, s katerim lahko raziskujemo, kako se v vodi topen protein vstavi v lipidno membrano. In tako deluje alfatoksin. Napade človeške in živalske celice, tako da omogoča stafilokoku vstop v celico skozi membrano in prispeva k izbruhu okužbe. Nas je zanimalo, kako se to zgodi, kako se lahko v vodi topni proteini tako zelo spremenijo, da vstopijo v membrano.
Kaj ste odkrili?
Kako se proteini vgradijo v celične membrane, je pomembno vprašanje temeljne znanosti. Ugotovili smo, da so proteini lahko uporabni v biotehnologiji. Gre za uporabo bioloških snovi za tehnološke aplikacije. Zanimalo nas je, ali lahko uporabljamo membranske proteine za aplikacije. Preverjali smo različne vrste uporabe, med drugim to, kako bi lahko uničili rakave celice ali vstavili molekule v celice tako, da bi jih potem lahko zamrznili.
Kakšna je uporabnost membranskih proteinov oziroma nanopor?
Najzanimivejša aplikacija membranskih proteinov je njihova uporaba kot osrednjih delov senzorjev. Membranski proteini, ki se sestavijo v pore, so šele v zadnjem času postali znani kot nanopore. Razvijamo nanopore za uporabo v senzorskih aplikacijah. Trenutno so v uporabi različni tipi nanopor, denimo proteinske nanopore, kot je alfatoksin, ali pore v trdnih materialih. Na uporabo membranskih proteinov smo se osredotočili zato, ker se jih da kemijsko ali genetsko spreminjati. Njihove lastnosti lahko izboljšamo.
Prva stvar, ki smo jo razvili, je bilo stohastično zaznavanje analitov, kar smo odkrili po naključju. Najprej smo razvili modificirane proteinske pore, ki vežejo določene majhne molekule, njihovo vezavo pa zaznavamo tako, da izmerimo tok, ki gre skozi pore. Ko so pore nameščene v membrani, lahko izmerimo tok, ki teče skoznje. Nosilci tega toka niso elektroni, ampak ioni v raztopini. Ko se molekula veže v poro, se spremeni tudi tok, ker se del pore zapolni z molekulo in ioni težje prehajajo skozi poro.
Ker analiziramo posamezne pore, zaznavamo snovi, ki vstopajo v poro, se vežejo nanjo z notranje strani in se potem odstranijo iz pore. Iz tega, kako hitro se spreminja tok, lahko sklepamo o količini in naravi snovi, ki vstopa v poro.
Te ugotovitve so bile podlaga za ustanovitev podjetja Oxford Nanopore Technologies. Kdo razen vas je sodeloval pri tem?
No, pravzaprav sem ga ustanovil sam leta 2005, toda takoj sem moral poiskati finančne vlagatelje. IP Group je prispeval zagonski kapital za ustanovitev podjetja. Vložili so približno pol milijona funtov.
To ni bil prav velik zagonski vložek.
Za začetek je bilo dovolj, toliko, da je podjetje fizično obstajalo, da je imelo direktorja in vsaj dva zaposlena znanstvenika. V naslednjem koraku pa smo lahko začeli zbirati več denarja. Danes je v podjetju več kot 250 zaposlenih. Sliši se veliko, ampak ponavadi je tako, da kmalu po zagonu podjetje dosega eksponentno rast.
Kaj je glavna dejavnost podjetja danes?
Osredotočeni smo na določanje zaporedij DNK. V tem smo zelo uspešni in zaradi tega je tako hitro naraslo število zaposlenih.
Ali to pomeni, da je na trgu veliko povpraševanje po vaši storitvi?
Je. Ko se je pred več kot desetimi leti začelo določanje zaporedij DNK pri človeškem genomu, je to samo pri enem človeku stalo približno milijardo dolarjev. Potem pa se je zgodila revolucija pri določanju zaporedij genoma. Ko je britansko podjetje Illumina začelo prodajati tehnologijo določanja zaporedij, so stroški za določanje zaporedij človeškega genoma strmoglavili; pred revolucijo so znašali več kot milijardo dolarjev, zdaj pa se gibljejo med 1000 in 5000 dolarji. Pocenitev je povzročila še eno revolucijo, in sicer v medicini, antropologiji in še kje, kjer so začeli uporabljati tako imenovano tehnologijo druge generacije določanja zaporedij DNK.
Naše podjetje Oxford Nanopore se ukvarja s tehnologijo tretje generacije določanja zaporedij DNK pri človeškem genomu. Naša tehnologija ima dve prednosti: je še cenejša od tehnologije druge generacije in veliko hitrejša. Zaporedja lahko določimo v manj kot eni uri. To je gromozanska sprememba v genomiki v zadnjih letih.
Revolucionarni preskok v tehnologiji odpira vrata številnim uporabnikom. Koliko je vreden svetovni trg DNK, če poenostavimo?
Tehnologija tretje generacije ni uporabna samo v medicini, ampak tudi v forenziki, antropologiji in morda še kje. Iz opisanega je razvidno, da je trg za določanje zaporedij DNK vreden več milijard dolarjev. Določanje zaporedij DNK postaja namreč standard v medicini. In konkurenca na tem področju je izjemno velika.
Nameravate s tem podjetjem vstopiti na borzo?
To ni izključeno, toda o vstopu na borzo ne odločam jaz, ampak upravni odbor. Podjetje je v desetih letih delovanja zbralo že 200 milijonov funtov kapitala za raziskave in razvoj, njegova vrednost pa je nekajkrat večja od omenjenega zneska.
Ustanovili ste še eno podjetje. S čim se ukvarja?
Imenuje se OxSy-Bio, ukvarja pa se s tridimenzionalnim tiskanjem lipidnih nanokapljic, ki so podobne celicam. Gre za tiskanje snovi, ki je videti kot tkivo. V prihodnosti bomo tiskali tudi žive celice.
Lahko natančneje opišete postopke tiskanja tkiva in celic ter njihovo uporabnost?
Če ima nekdo srčni napad in del tkiva v srcu odmre, takemu pacientu ne bo treba zamenjati srca, ampak se bo samo odstranil odmrli del srca oziroma srčnega tkiva in se zamenjal z novim, vzgojenim v laboratoriju.
Menim, da se bo zaradi nove tehnologije v zaznavanju genoma hitro razvijala tudi medicinska tehnologija, in sicer tako, da bo postala veliko cenejša in bolj dostopna za vse. Razvoj genomike bo koristil vsem pacientom, tudi revnim, predvsem pa bo pomagal pri zdravljenju rakavih obolenj, saj bo za ceno največ tisoč dolarjev že v eni uri »odčitano«, kakšne so spremembe DNK v genomu pacientov, to pa bo pomagalo pri določanju terapije. Če vemo, da stane zdravljenje rakavega bolnika 100.000 dolarjev na leto, bo napredek v genomiki verjetno vplival na znižanje stroškov zdravljenja tudi najhujših obolenj.
 Tiskane izdaje
Tiskane izdaje