- Četrtek, 31. julij 2025
- Delo home
-
Neomejen dostop | že od 14,99€
Kaj prinaša zdravljenje kroničnih imunskih bolezni po meri posameznika

Personalizirana medicina je sodoben pristop zdravljenja, pri katerem se zdravstvene odločitve, diagnostični postopki, terapevtski posegi in/ali izbira ter odmerjanje zdravil prilagajajo posameznemu bolniku, na podlagi njegovih bioloških, predvsem genetskih značilnosti. Tako se upošteva biološka edinstvenost vsakega bolnika, kar omogoča bolj ciljno, učinkovito in varno zdravljenje, s kar najmanj neželenimi učinki.

Personalizirana medicina pomeni, da že pred začetkom zdravljenja opravimo analizo biooznačevalcev in na podlagi dobljenih rezultatov izberemo najprimernejše zdravilo oziroma prilagodimo odmerek.
Klasična zdravila
Pri klasičnih zdravilih, tako imenovanih majhnih sinteznih molekulah, podskupine bolnikov pogosto določamo prav na podlagi njihove sposobnosti presnove zdravil. Klasična zdravila so običajno pridobljena s kemično sintezo v laboratoriju (»v epruveti«) in pogosto nimajo naravnega ustreznika v človeškem telesu. Zato jih telo prepozna kot ksenobiotike – tuje snovi, ki jih mora čim prej razgraditi in izločiti.
Pri tem imajo ključno vlogo encimi, predvsem iz družine citokromov P450 (CYP450). Vsak posameznik ima unikaten genetski zapis za te encime, kar pomeni, da je učinkovitost presnove zdravil med bolniki lahko zelo različna. Tako ločimo počasne, srednje hitre in ultrahitre presnavljavce. Pri počasnih presnavljavcih lahko zdravilo ostane predolgo v telesu in povzroča neželene učinke, medtem ko se pri ultrahitrih razgradi prehitro in izgubi terapevtski učinek. Takšen pristop se že uveljavlja v klinični praksi, na primer pri zdravilih, kot so klopidogrel, varfarin ali triciklični antidepresivi, kjer je odziv bolnika močno odvisen od genetskih polimorfizmov v genih za encime CYP450. Za lažje klinično odločanje so danes na voljo tudi farmakogenetske izkaznice oziroma digitalne aplikacije, ki na podlagi genetskega profila posameznika svetujejo ustrezno izbiro in odmerjanje zdravil.
Biološka zdravila
Koncepta polimorfizmov v genih za presnovo zdravil kot biooznačevalcev za personalizirano medicino žal ne moremo uporabiti za biološka zdravila, saj jih naše telo ne presnavlja po enakih poteh kot ksenobiotike. Biološka zdravila trenutno predstavljajo 30 odstotkov celotnega trga zdravil in so najhitreje rastoč sektor na njem. Praviloma so učinkovitejša od klasičnih, saj jih večina po načinu delovanja spada med tarčna zdravila, kar pomeni, da se specifično vežejo na tarčne molekule. Najpogosteje so to beljakovinski receptorji in signalne beljakovine, ki so neposredno vpletene v same molekularne mehanizme nastanka bolezni. Biološka zdravila se tako uporabljajo večinoma za najtežje oblike bolezni, za katere klasična niso učinkovita ali povzročajo preveč neželenih učinkov. Žal se lahko tudi pri bioloških zdravilih pojavi slabša odzivnost (po več mesecih terapije), predvsem kot posledica tvorbe protiteles proti tem zdravilom, pri nekaterih boleznih in zdravilih pa se ta pojavi že takoj ob uvedbi terapije. Zaradi visoke cene bioloških zdravil in trenda njihove razširjene uporabe tudi v zgodnejši fazi bolezni so nujne raziskave biooznačevalcev za personalizirano medicino.
Poglobljene raziskave in razvoj lastne biobanke
Cilj raziskav združene skupine raziskovalcev Centra za humano molekularno genetiko in farmakogenomiko (CHMGF) na Medicinski fakulteti in Laboratorija za biokemijo, molekularno biologijo in genomiko na Fakulteti za kemijo, kemijsko tehnologijo in genomiko Univerze v Mariboru, je predvsem poglobljeno razumevanje molekularnobioloških procesov, mehanizmov poteka bolezni in odziva na zdravljenje z biološkimi zdravili pri bolnikih s kroničnimi imunskimi boleznimi in rakom.
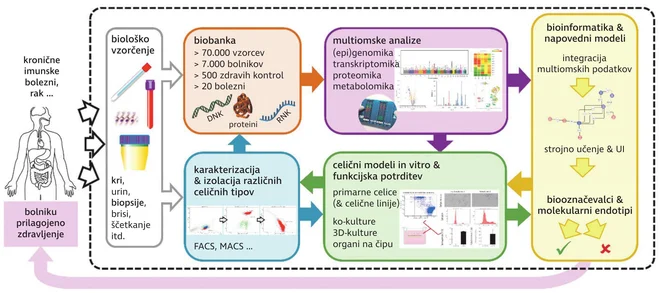
Razumevanje molekularnih mehanizmov (ne)odzivnosti nam omogoča odkrivanje biooznačevalcev, povezanih z odzivom na zdravljenje, in molekularne tarče za načrtovanje novih zdravil, ki bi bila učinkovita pri bolnikih, za katere obstoječa zdravila niso uspešna.
Za izvajanje takšnih raziskav smo razvili obsežno biobanko kliničnih vzorcev, v katero je trenutno vključenih več kot 7000 slovenskih bolnikov, za več kot 20 različnih bolezni. Biobanka MF UM je zgrajena v skladu z mednarodnimi raziskovalnimi protokoli in je del evropske biobančne infrastrukture BBMRI-ERIC (Biobanking and Biomolecular Resources Research Infrastructure – European Research Infrastructure Consortium). Edinstvenost naše biobanke je v pristopu sistemske medicine in sistemske biologije, in sicer na način, da pri istem bolniku odvzamemo klinične biološke vzorce iz različnih tkiv in tekočin (kri, tkiva, slina, bris sluznice, urin, blato, izdih), iz njih pa izoliramo različne biomolekule (DNA, RNA, proteine) ter celice za direktne analize ali/in razvoj funkcionalnih celičnih modelov.

Skupno je v biobanko vključenih že več kot 70.000 vzorcev. Za večino bolnikov vzorce odvzamemo pred uvedbo novega zdravila in med samim potekom zdravljenja, saj tako spremljamo tudi podatke o učinkovitosti zdravljenja in neželenih učinkih. Dosedanje raziskave odziva na biološka zdravila so pokazale, da v nasprotju s klasičnimi zdravili samo posamezni genetski polimorfizmi ne bodo dovolj zanesljivi biooznačevalci za personalizirano medicino, temveč bo potrebna globalna analiza genoma na več ravneh, ki jo omogočajo tako imenovane tehnologije multiomik. V našem centru CHMGF na Medicinski fakulteti Univerze v Mariboru imamo na enem mestu celotno najsodobnejšo infrastrukturo za multiomske analize, kar je edinstveno v slovenskem prostoru. Ob tem imamo za multiomske analize tudi ekspertize, ki vključujejo genomiko, s katero preučujemo variabilnost in napake (mutacije) v celotnem genetskem zapisu (analiza GWAs, sekvenciranje naslednje generacije (NGS)), transkriptomiko, s katero preučujemo izražanje (aktivnost) vseh genov hkrati, epigenomiko, s katero preučujemo regulacijo genskega izražanja, in proteomiko, s katero ugotavljamo, v kolikšni meri so proteini prisotni v posameznih tkivih ter kako med seboj sodelujejo pri uravnavanju bioloških procesov. Z aparatom za razvrščanje celic lahko multiomske podatke pridobivamo ločeno za posamezne podtipe celic in v zadnjem času tudi za vsako posamezno celico. Te zmogljive tehnologije generirajo ogromne količine podatkov, ki jih obdelujemo z naprednimi bioinformatskimi analizami. Za bolj poglobljene študije molekularnih mehanizmov (ne)odzivnosti in validacijo odkritih multiomskih biooznačevalcev uporabljamo še funkcionalne celične modele oziroma organe na čipu, s katerimi poskušamo čim bolj posnemati delovanje biološkega zdravila v telesu bolnika.
Personalizirano zdravljenje kroničnih imunskih bolezni
Trenutno se največ posvečamo raziskavam astme in kronične vnetne črevesne bolezni. S partnerji v mednarodnih konzorcijih za farmakogenetske raziskave otroške astme PiCA, SySPharmPhedia in Permeable si prizadevamo pripraviti znanstvene podlage za izdelavo mednarodnih smernic za personalizirano zdravljenje astme. Čeprav se večina bolnikov dobro odziva na trenutno najbolj razširjeno standardno zdravljenje z inhalacijskimi kortikosteroidi (IKS), jih ima približno od pet do deset odstotkov, kljub uporabi visokih odmerkov IKS in dolgo delujočih β₂-agonistov, hudo obliko astme. Ta povzroča slabšo kakovost življenja, pogosta poslabšanja, hospitalizacije, stranske učinke zdravljenja in visoke stroške. Doseganje nadzora nad simptomi pogosto temelji na pristopu »poskusov in napak«, kar vodi v slabše zdravstveno stanje, pogostejše hospitalizacije in večje obremenitve zdravstvenega sistema.
V naši raziskavi smo, na vzorcu več kot 3000 bolnikov z otroško astmo, izvedli asociacijsko študijo v celotnem genomu. Z nadaljnjo integracijo genomskih podatkov s podatki profila izražanja genov (transkriptoma), epigenomskimi podatki bolnikov ter s podatki, pridobljenimi na funkcionalnem celičnem modelu, tretiranem z IKS, smo odkrili ključne gene (CACNA2D3-WNT5A, LTBP1, BIRC3), povezane z odzivom na IKS. Na podlagi teh biooznačevalcev lahko predvidimo podskupine bolnikov, ki bodo najprimernejši za učinkovito zdravljenje, z različnimi biološkimi zdravili, ki so že široko v uporabi pri bolnikih z odraslo astmo. Trenutno je tudi v Sloveniji za zdravljenje hude astme na voljo več bioloških zdravil, ki ciljajo na različne molekularne tarče in signalne poti, vključno z omalizumabom (OMA), ki ciljno znižuje raven krožečega imunoglobulina E (IgE).
Odziv bolnikov na ta zdravila je zelo različen, zato je pogosto treba zdravljenje po nekaj mesecih ali letih spremeniti. Obstoječe mednarodne smernice za zdravljenje astme priporočajo uporabo bioloških zdravil na podlagi kliničnih znakov in biooznačevalcev, kot sta število eozinofilcev in nivo IgE, vendar te smernice niso dovolj natančne za napoved individualnih odzivov.

V projektu Permeable smo razvili inovativen farmakogenomski celični model za preučevanje zdravljenja z omalizumabom (OMA) pri astmi. V tem modelu smo povezali test aktivacije bazofilcev (BAT), ki se trenutno široko uporablja v klinični praksi za diagnosticiranje za bolnika specifičnih vrst alergij, z zdravljenjem in vitro z OMA in visokozmogljivo transkriptomsko analizo. Pred začetkom zdravljenja uporabljamo primarne krvne celice bolnikov, aktiviramo bazofilce z alergeni, značilnimi za vsakega posameznika, in njihove celice in vitro izpostavimo OMA, s čimer posnemamo zdravljenje v živem organizmu (in vivo). Tako lahko preverimo učinkovitost delovanja zdravila OMA pri vsakem posameznem bolniku, še preden ta zdravilo dejansko prejme.
Podobno kot za astmo je več bioloških zdravil na voljo tudi za zdravljenje hujših oblik kronične vnetne črevesne bolezni (KVČB), kamor sodita Crohnova bolezen (CB) in ulcerozni kolitis. Biološka zdravila za KVČB vključujejo adalimumab (ADA, zaviralec TNFα) in vedolizumab (VDZ, zaviralec integrinov). Kljub razširjeni uporabi teh zdravil še zmeraj ni enotnih smernic za njihovo prednostno izbiro. Pogosto to pomeni, da je treba pri nekaterih bolnikih, zaradi neodzivnosti, zdravilo med zdravljenjem zamenjati tudi do petkrat. V eni izmed raziskav odziva na adalimumab pri bolnikih s CB smo odkrili več ključnih genov, povezanih z odzivom. Razvili smo celični model, s katerim smo pokazali, da diferenciacija monocitov v makrofage, ki proizvajajo veliko IL1B (makrofagi M1), pomembno vpliva na neodzivnost na zdravljenje. Z rezultati naše študije smo spodbudili nadaljnje raziskave inhibitorjev IL1B, kot potencialnega novega zdravila za zdravljenje KVČB pri bolnikih, ki so neodzivni na ADA. Trenutno razvijamo nov inovativni celični model za preučevanje učinka VDZ pri Crohnovi bolezni, ki posnema okolje črevesnih krvnih žil. Zaviralec integrinov (VDZ) deluje tako, da zavira vezavo integrina α4β7 na krvnih levkocitih z adhezijsko molekulo MAdCAM-1 na endotelijskih celicah. S tem preprečuje prehajanje levkocitov iz žil v črevesno sluznico in posledično zmanjšuje čezmerno vnetje. Uporabljamo krvne vzorce bolnikov, iz katerih z diferenciacijo pridobimo primarne endotelijske celice in jih skupaj z njihovimi imunskimi celicami vključimo v tako imenovani organ na čipu.

Izzivi in cilji
Izziv prihodnjih translacijskih raziskav je predvsem, kako veliko množico pridobljenih multiomskih podatkov za posameznega bolnika povezati z njegovimi kliničnimi podatki ter kako z uporabo naprednih računalniških algoritmov in umetne inteligence razviti učinkovite napovedne modele, ki jih bo mogoče vključiti v aplikacije in bodo prijazni za uporabo zdravnikom v njihovi vsakdanji klinični praksi. Za dosego teh ciljev na Medicinski fakulteti Univerze v Mariboru prihodnje leto načrtujemo popolno avtomatizacijo in digitalizacijo tako biobanke kliničnih vzorcev kot laboratorijskih procesov pridobivanja multiomskih podatkov. Razviti želimo digitalno platformo multiomskih in kliničnih podatkov v strukturirani obliki, kar nam bo omogočilo učinkovitejše odkrivanje biomarkerjev. V nadaljevanju načrtujemo prospektivne validacijske študije, s katerimi bomo lahko primerjali učinkovitost obravnave bolnikov po utečeni praksi z obravnavo bolnikov s pomočjo na novo razvite digitalne platforme, ki omogoča zdravljenje po meri posameznika.
–––
Prof. dr. Uroš Potočnik je redni profesor na Medicinski fakulteti in Fakulteti za kemijo in kemijsko tehnologijo Univerze v Mariboru ter predstojnik Centra za humano genetiko in farmakogenomiko na MF UM.


Komentarji